Инфекционную болезнь важно рассматривать как сложный многокомпонентный процесс, в составе которого имеет смысл различать прежде всего место проникновения, или ворота инфекции. Для одних возбудителей местом проникновения является желудочно-кишечный тракт, для других — дыхательные пути, для третьих — кожный покров. Очевидно, что ворота инфекции сформировались в ходе длительной эволюции и являются следствием активного внедрения возбудителя с не менее активным противодействием со стороны макроорганизма. Итогом этого взаимодействия стало появление новых признаков, строго закрепленных как за возбудителем, так и за макроорганизмом. Можно даже допустить, что эти изменения или даже свойства закрепились на генетическом уровне и в этом смысле стали неотъемлемой частью возбудителя. Таким образом, мы допускаем, что способность возбудителя инфекционной болезни проникать в макроорганизм тем или иным путем имеет врожденный характер, и следовательно, ворота инфекции —это генетически закрепленный признак у всех патогенов, и они не могут меняться в зависимости от случайностей или недетерминированных обстоятельств. В обобщенном виде эти особенности входят в понятие тропного органа. В конечном итоге тропным органом можно называть биологический субстрат, в котором возбудитель находит оптимальные условия для размножения. Для достижения этой главной цели патоген-возбудитель должен иметь возможность прикрепления к субстрату через родственный клеточный рецептор, иметь возможность или энергию преодолеть клеточную мембрану (для патогенов-вирусов), запустить процесс сборки возбудителя на основе использования клеточного материала хозяина-макроорганизма. С учетом этих обстоятельств становятся понятными причины невозможности заразиться инфекционным заболеванием путем простого введения патогена в обход тропного органа и ворот инфекции. Очевидно, что только при условии наличия тропного органа возбудитель имеет возможность передать все факторы патогенности, инвазивности, т.е. влить весь свой генетический материал и передать свой генетический код с программой действия в условиях осуществляющей агрессии. Патоген в этом случае действует как самостоятельный, хорошо «вооруженный» и укомплектованный участник взаимодействия. С научной точки зрения, необходимо организовать исследование на всех этапах действия патогена на молекулярном уровне. На практике для нас принципиально понимать, что в зоне внедрения, как правило, возникает очаг воспаления. Так, например, при гриппе воспалительный процесс развивается преимущественно в эпителии трахеи и крупных бронхов, при респираторно-синцитиальной вирусной инфекции — в эпителии бронхиол, при риновирусной инфекции — в эпителии полости носа и придаточных пазух носа и т.д. Таким образом, с практической точки зрения, можно и нужно для каждого возбудителя определить его тропный орган, поскольку такой подход позволяет осуществлять диагностику инфекционной болезни по этиологическому признаку на основании характеристики возникающего морфологического субстрата в тропном органе.
Изменить тропность искусственным путем обычно невозможно, но все же в редких случаях можно вызвать, например, корь, краснуху, паротит и другие болези гематогенным введением возбудителя. Это может удасться только в том случае, если обстоятельства будут способствовать попаданию патогена и в тропный орган, как, например, при массивном заражении, где ему, возможно, «повезет», и он «зацепится» за родственный рецептор, сможет пенетрировать и запустить процесс воспроизводства. Примером такого заражения могут послужить случаи вакцино-ассоциированной кори, краснухи, эпидемического паротита. Одновременно с этим важно напомнить, что нельзя заразить, например, холерой или шигеллами через клизму, даже если доза патогена будет в миллионы раз превышать таковую, которую получают при естественном заражении через рот. Таким образом, ворота инфекции в совокупности с тропностью играют решающую роль в патогенезе любого инфекционного заболевания. Процесс всегда осуществляется в рамках лиганд-рецепторного взаимодействия.
С одной стороны, имеется возбудитель, который активен, вооружен всеми факторами, обеспечивающими ему нахождение родственного рецептора в субстрате, проникновение в его внутреннюю среду, размножение и взаимодействие с субстратами хозяина.
С другой — макроорганизм, обеспеченный системой защиты от проникновения, без всякого «желания» пустить допустить размножение. Очевидно также, что система защиты бывает многоуровневой. Первая встреча происходит в тропном органе, где возбудитель в момент встречи запускает все механизмы агрессии. Если все составляющие совпадают, возникает патогенетическое взаимодействие, и развивается характерная клиническая картина инфекционного заболевания. Очевидно, что присутствие возбудителя в воротах инфекции и вызываемые им реакции воспаления приводят к некробиозу и деструкции, привлекают в очаг воспаления клетки иммунного реагирования, в первую очередь макрофаги. В результате запускается общепринятая схема детерминированных реакций, когда полная информация о возбудителе посредством медиаторов иммунного реагирования передается Т-звену иммунитета, и в циркуляции появляются Т лимфоциты-хелперы, супрессоры, киллеры и др. Аналогичным образом информация о возбудителе передается В-звену иммунитета с формированием глобулинпродуцирующих плазматических клеток: так запускается механизм продукции специфических антител.
С этого момента весь процесс стремится к завершению и в большинстве случаев заканчивается полным саногене-зом. Следовательно, для полноценного иммунного ответа предполагается обязательное присутствие возбудителя в тропном органе, где он наиболее полно реализует свои возможности как фактор агрессии, и где происходит первая встреча агрессора со всеми факторами иммунного реагирования, включая секреторные иммуноглобулины — интерферон, неспецифические факторы защиты и т.д. На этом начальном этапе происходит своеобразная разведка боем. Особенно важно, что в воротах инфекции возбудитель приобретает новые качества, необходимые для достижения всех целей агрессии, в первую очередь цели воспроизводства. С другой стороны, система иммунитета организма получает полную информацию о возбудителе, перестраивается и готова реализовать все свои возможности по элиминации возбудителя и полного саногенеза. Это имеет место в случае, если заражение происходит естественным путем — через желудочно-кишечный тракт, дыхательные пути или кожные покровы. В случае если возбудитель попадает непосредственно в кровь и гематогенным путем разносится по всему организму, он не может проникнуть в тропный орган, и следовательно, не формируется первичный очаг инфекции. Этот патоген не может быть полноценным с точки зрения реагирования иммунной системы макроорганизма, поскольку в его создании не принимали участие, например, секреторные иммуноглобулины и другие факторы местного иммунитета. В этом случае создаются условия для длительной персистенции возбудителя, т.е. формирования хронической или даже «медленной» инфекции с прогредиентным течением. Присутствие патогена в крови и его неполноценное взаимодействие с факторами иммунитета не может закончиться полным саноге-незом и является основанием для изменения тропности у возбудителя. Вполне очевидно, что этот процесс инициируется на молекулярном уровне и пролонгирован во времени. Происходит постепенное накапливание частичных признаков в структуре возбудителя. Они постепенно приближают патоген к новым вариантам агрессии. Примерно такие же процессы наблюдали при последней пандемии гриппа А с антигенной формулой H1N1 (swin). Как известно, до июня 2009 г. заболеваемость гриппом А была обусловлена вариантами вируса гриппа А, для которых тропным органом был эпителий верхних дыхательных путей, преимущественно трахеи и крупных бронхов. Незадолго до последней гриппозной пандемии у вируса гриппа А произошли небольшие изменения в структуре за счет присоединения сиаловых кислот, благодаря чему появилась тропность к нижним дыхательным путям. Начались массовые заболевания людей, в процесс были вовлечены и те, кто уже переболел гриппом А H1N1. Результатом стала пандемия, при которой поражались в основном нижние дыхательные пути, тогда как привычного поражения трахеи и крупных бронхов не наблюдалось. В клинической картине нового гриппа имел место тяжелый острый респираторный дистресс-синдром с отеком легкого, быстро прогрессирующим кислородным голоданием и нередко летальным исходом. Здесь мы видим, как в условиях длительной циркуляции вируса гриппа А H1N1 на фоне тотального противогриппозного иммунитета возник новый вариант возбудителя за счет ничтожно малой его изменчивости, следствием чего явились изменение тропности, «уход» возбудителя от иммунологического прессинга и способность вызывать поражение нижних дыхательных путей.
Еще более показательным примером в этом смысле является изменение тропности у герпетических инфекций. Известно, что многие вирусы семейства герпеса, в первую очередь цитомегаловирус, вирус Эпштейна—Барр, а также вирус герпеса человека 6-го типа, обладают тропностью к лимфоретикулярной ткани. Это означает, что заражение этими вирусами происходит воздушно-капельным или контактным путем, т.е. через носоглотку; при этом возникает картина инфекционного мононуклеоза, которая, как известно, сопровождается повышением температуры тела и поражением глоточного кольца с гиперплазией лимфоидных образований ротоглотки, увеличением лимфатических узлов, а также печени и селезенки, в крови увеличивается число клеток лимфомоноцитарного ряда, появляются атипичные мононуклеары. Течение болезни в этих случаях всегда острое и заканчивается выздоровлением. Принципиально иная картина наблюдается при заражении вирусами герпеса не через глоточное кольцо, а парентерально — через кровь. В этом случае поражения ротоглотки не происходит, а заболевание манифестирует клинической картиной вирусного гепатита с начальным кратковременным подъемом температуры, болями в животе, желтухой, в крови резко увеличивается активность печеночно-клеточных ферментов АлТ и АсТ, повышается содержание конъюгированного билирубина, т.е. клинические проявления полностью тождественны таковым при вирусных гепатитах А или В. Примечательно, что заболевание в дальнейшем зачастую принимает хроническое течение и нередко приводит к формированию цирроза печени. В крови у всех этих больных определяются маркеры цитомегалии, вируса Эпштейна—Барр или вируса герпеса 6-го типа. Более того, в пунктатах печени иммуногистохимическим методом обнаруживают антигены герпетических вирусов, а также их ДНК, тогда как обследование на маркеры вирусов гепатита A, B, C и других гепатотропных вирусов всегда бывает отрицательным. Эти данные позволяют нам говорить о смене тропности у вирусов семейства герпеса.
В ходе персистенции вирусы семейства герпеса приобрели тропность к клеткам печени и одновременно потеряли тропность к лимфоидным образованиям ротоглотки, лимфатическим узлам, скоплениям лимфоретикулярной ткани. Можно допустить, что за счет изменения тропности вирусы семейства герпеса способны (и, по-видимому, часто) поражать другие органы и системы, в т.ч. сердце, легкие, почки, желудочно-кишечный тракт и др. Мы также допускаем, что изменение тропности является широко распространенным явлением, лежащим в основе формирования многих хронических и, возможно, «медленных» инфекций; это генетически детерминированная способность возбудителя уклониться от иммунологического надзора. Существуют все основания полагать, что изменение тропности имеет место при подостром склерозирующем панэнцефалите в исходе коревой инфекции, опоясывающем герпесе в исходе ветряной оспы, многих хронических заболеваниях центральной нервной системы с прогредиентным течением, а также при всех других инфекциях, при которых патологический процесс развивается не по законам естественного течения, стартуя с попадания патогена в кровь. Такие условия создаются при парентеральном инфицировании, в т.ч., возможно, и при перинатальном или даже трансплацентарном инфицировании. В этих случаях ворота инфекции не образуются, и в результате не происходит первичной полноценной презентации возбудителя всем компонентам иммунной системы и его элиминации. Возбудитель получает возможность полностью реализовать свой генетический код жизни, конечно, в новых условиях и под постоянным надзором иммунной системы макроорганизма. Одновременно патоген ведет активный поиск в направлении возможности поражения новых субстратов, и в конечном итоге — новых органов. И поскольку поражение любого органа зависит от присутствия рецепторов прикрепления, проникновения и размножения, происходит постоянная селекция и отбор тех клонов возбудителя, которым удалось больше других достичь успехов на пути к конечной цели — размножению.
Высказанные нами положения позволяют глубже понять группу инфекционных заболеваний, объединенных термином «медленные инфекции». По сегодняшним представлениям, «медленная» инфекция — это особая форма инфекционного заболевания, возбудитель которого способен к пожизненной персистенции. Термин «медленная инфекция» пришел к нам из ветеринарии, где он используется для обозначения смертельных заболеваний овец, таких как скрепи, висна, меди.
В настоящее время показана роль «медленных» инфекций и в патологии человека: они характеризуются пожизненной персистенцией возбудителя, итогом которой являются хронические виды патологии от атеросклероза до частых онкологических, эндокринологических и неврологических заболеваний. Более того, существуют все основания считать, что даже такие заболевания, как неспецифический язвенный колит, болезнь Крона и другие аутоиммунные болезни, перейдут в разряд инфекционных, с той лишь поправкой, что заражение и распространение патогена происходит через кровь, в результате чего отсутствует полный саногенез, но в органах-мишенях формируется аутокомплекс, состоящий из трансформированного органа-мишени и инфекционного патогена, запускающего реакции аутоиммунной агрессии. По сути, то же самое мы видим и при ВИЧ-инфекции или гепатитах В, С. Как известно, при таких инфекциях заражение всегда происходит через кровь, и при этом не возникает полноценного иммунного ответа, но зато прогрессируют реакции аутоиммунной агрессии, и в динамике заболевания в патологический процесс постепенно вовлекаются все новые органы, что демонстрирует постепенное изменение тропности.
В обобщенном виде патогенез инфекционного заболевания можно представить следующим образом. Принципиально важно различатъ ворота инфекции. Под этим термином мы понимаем не только место проникновения патологического агента, но прежде всего ряд последовательных событий на молекулярном, клеточном, иммунологическом уровне, направленных на формирование принципиально нового участника процесса, а именно возбудителя, который находится в тесном взаимодействии с компонентами местного и общего иммунитета, медиаторами и многими другими факторами, дающими воротам инфекции право самостоятельно действовать, в т.ч. запускать генетический код с программой агрессии. В дальнейшем процесс протекает в полном соответствии с генетическим кодом агрессии. При естественном пути заражения возбудитель проникает через слизистые оболочки верхних дыхательных путей и желудочно-кишечного тракта или через кожный покров и обычно сразу оказывается в тропном органе, что предопределяет формирование полноценных ворот инфекции. Заболевание принимает острое циклическое течение, и, с морфологической точки зрения, процесс заканчивается на уровне тропного органа. Клинически заболевание манифестирует легкими, среднетяжелыми или даже тяжелыми формами вплоть до фульминантных форм с летальным исходом. Хронические формы в этих случаях не развиваются, по-скольку длительность заболевания регламентируется наличием тропного субстрата, имеющего анатомические ограничения.
Хронические формы инфекции возникают только в том случае, если заражение происходит артифи-циальным путем, т.е. непосредственно через кровь. В этом случае не формируются полноценные ворота инфекции, и не возникают условия для элиминации возбудителя. Заболевание принимает хроническое течение. Возбудитель попадает в условия т.н. биологического тупика, когда доступ к тропному субстрату невозможен из-за отсутствия полноценных ворот инфекции. В отсутствие доступа к естественным путям заражения инициируется поиск нового субстрата тропности, когда возбудитель, циркулируя в крови и оказывая постоянный прессинг на иммунную систему, в т.ч. и на уровне отдельных внутренних органов, находит новый тропный субстрат в висцеральном органе или органах. Примером этого может послужить появление тропности у вируса гриппа A H1N1 (swin) к эпителию нижних дыхательных путей, а у герпетических вирусов — к гепатоцитам, в результате чего появились острые и хронические герпетические гепатиты, неотличимые по клиническим проявлениям от острых и хронических гепатитов В и С. По нашему мнению, механизм смены тропности — широко распространенный универсальный процесс. Особенно показательно он проявляется при ВИЧ-инфекции, когда на протяжении всего заболевания в процесс вслед за Т лимфоцитами последовательно вовлекаются центральная нервная, сердечно-сосудистая система и др. Аналогичным образом протекают хронические инфекции, в т.ч. и аутоимунные заболевания, а возможно, и все «медленные» инфекции. При всех этих заболеваниях первичной является персистирующая инфекция, активность которой поддерживается появлением все новых и новых субстратов тропности, что, собственно, и поддерживает весь процесс. Его можно считать основным патогенетическим звеном любой хронической инфекции. Предположительно, после разрушения тропного субстрата активность процесса должна снижаться или даже прекращаться. Однако так происходит далеко не всегда, поскольку существует большая вероятность появления тропного субстрата в других органах. Теоретически, процесс может закончиться фибро-зированием многих органов и систем.
Основные положения
• Клиническая картина инфекционного заболевания, характер течения, ближайшие и отдаленные исходы определяются воротами инфекции (путем заражения). Если заражение происходит естественным путем (ротоглотка, дыхательные пути, желудочно-кишечный тракт), возникает адекватный иммунный ответ, заболевание манифестирует типичными клиническими симптомами, протекает циклично и заканчивается выздоровлением с формированием полноценного стерильного иммунитета. В случае если возбудитель стартует гематогенным (парентеральным) путем, в т.ч. и перинатально, полноценного иммунного ответа не развивается, заболевание принимает хроническое течение с вовлечением в процесс висцеральных органов. При этом стерильный иммунитет не формируется.
При гематогенном (парентеральном) пути инфицирования невозможен адекватный иммунный ответ. Для полного саногенеза необходимо присутствие возбудителя или его медиаторов из тропного органа. На роль медиаторов тропности могут претендовать секреторные иммуноглобулины.
ВИЧ-инфекция, вирусные гепатиты С, В, столбняк, бешенство и другие инфекции, протекающие с поражением висцеральных органов, а также все «медленные» инфекции можно трактовать как инфекционные заболевания с гематогенным путем заражения, развивающиеся за счет механизма изменения тропности, обеспечивающего последовательное вовлечение в процесс висцеральных органов.
Задачей на будущее является проведение научных исследований на предмет поиска конкретных медиаторов иммунного реагирования, запускающих и контролирующих все этапы взаимодействия возбудителя и макроорганизма, как, например, обнаружение в составе секреторных иммуноглобулинов медиаторов, маркирующих активацию этого звена при циклически протекающих инфекциях.
Использование таких медиаторов в качестве лекарственного средства позволит вмешиваться в процесс формирования полноценных ворот инфекции или подавлять у возбудителя потенциал смены тропности. Наши представления о воротах инфекции, об изменениях тропности могут быть весьма полезны и при конструировании мукозальных вакцин. С их помощью можно будет предотвращать дефекты в системе местного иммунитета.
Учение о воротах инфекции, тропности, возникновении тропного субстрата в висцеральных органах могут составить основу современной инфектологии.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1. Шерлок Ш., Дули Дж. Заболевания печени и желчных путей. 1999. 864 с.
2. Учайкин В.Ф., Чередниченко Т.В., Смирнов А.В. Инфекционная гепатология. М.: ГЭОТАР-Медиа. 2012. 640 с.
3. Майер К.-П. Гепатит и последствия гепатита. 1999. 432 с.
4. Учайкин В.Ф., Нисевич Н.И., Чередниченко Т.В. Вирусные гепатиты от А до TTV у детей. М.: Новая волна. 2003. 432 с.
КОНТАКТНАЯ ИНФОРМАЦИЯ
Учайкин Василий Федорович, доктор медицинских наук, профессор, академик РАМН, заведующий кафедрой инфекционных болезней у детей № 1 педиатрического факультета ГБОУ ВПО «РНИМУ им. Н.И. Пирогова» МЗ РФ Адрес: 117997, Москва, ул. Островитянова, д. 1; тел.: (916) 123-44-80; e-mail: uchaikin@list.ru
Шамшева Ольга Васильевна, доктор медицинских наук, профессор, заведующая кафедрой инфекционных болезней у детей № 2 педиатрического факультета ГБОУ ВПО «РНИМУ им. Н.И. Пирогова» МЗ РФ Адрес: 117997, Москва, ул. Островитянова, д. 1; тел.: (916) 516-22-57; e-mail: ch-infection@mail.ru
https://cyberleninka.ru/article/n/konts … oy-bolezni
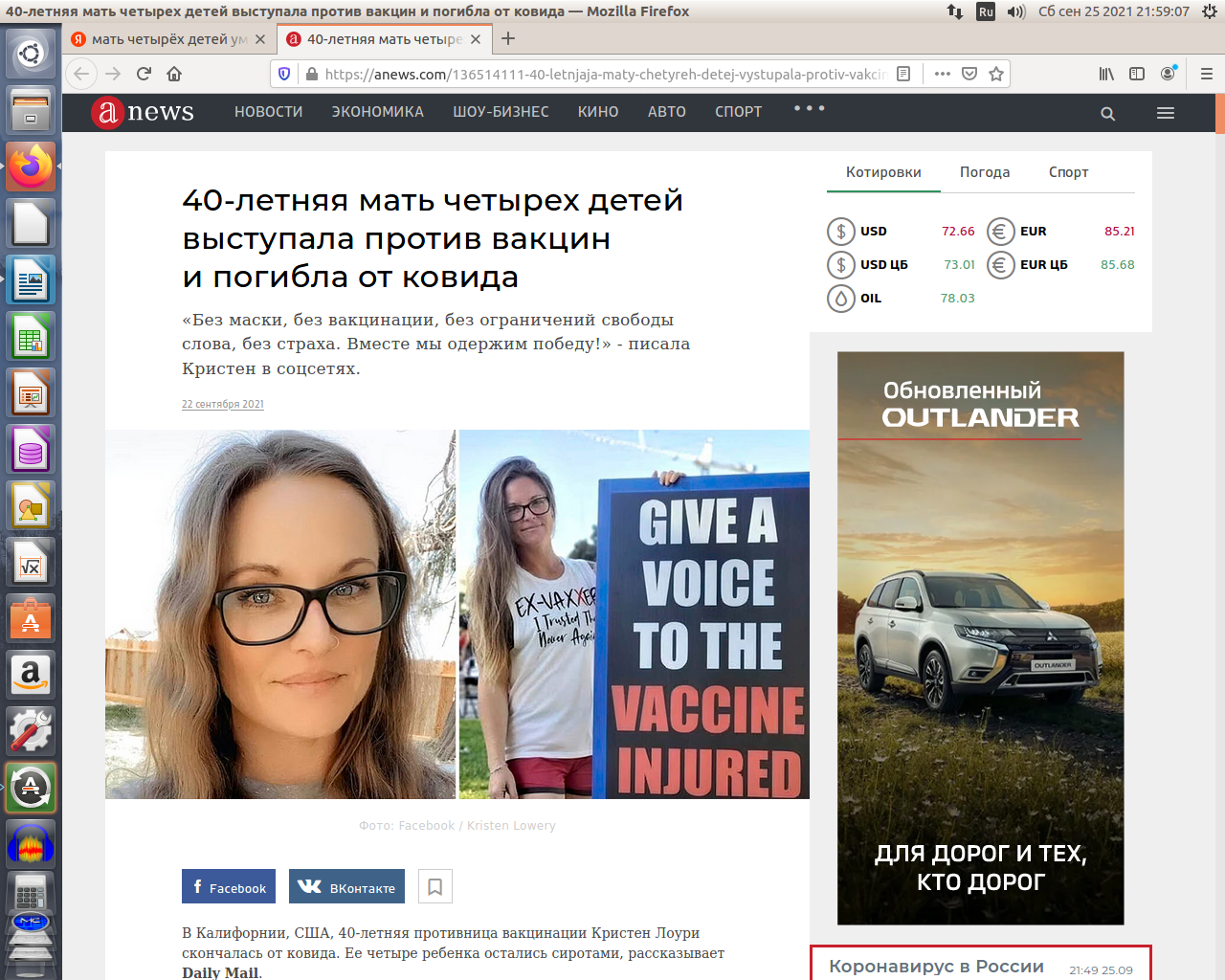
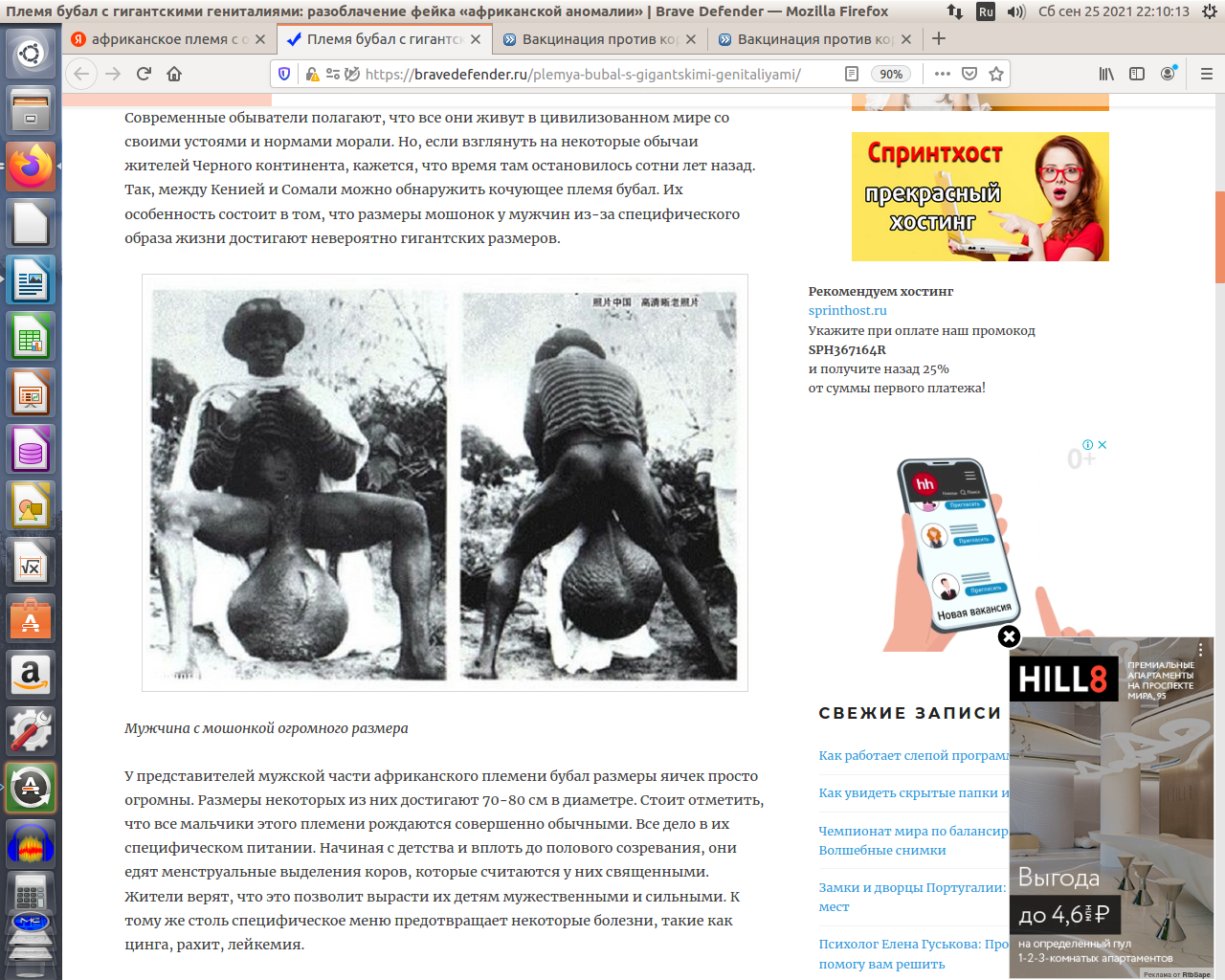

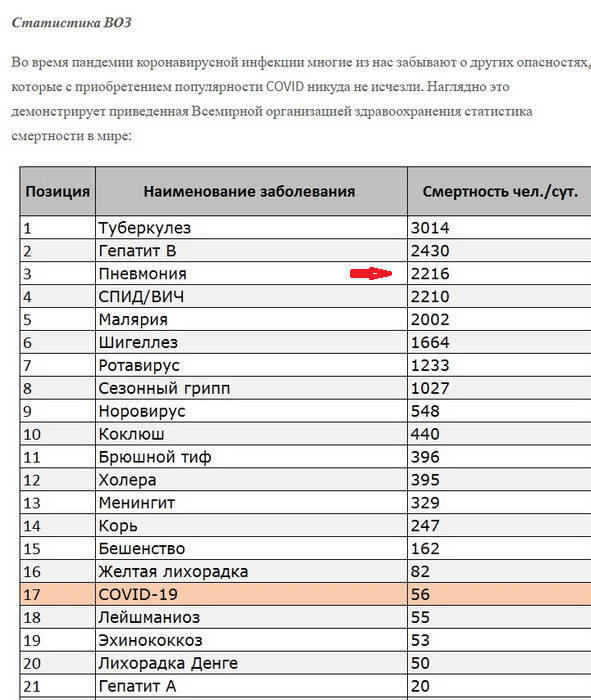
 может ГУФ Goodil хитрый ход делает и задача цель как раз наоборот..
может ГУФ Goodil хитрый ход делает и задача цель как раз наоборот..




 Люди, которые никогда не интересовались ни биологией, ни вирусологией, - вдруг начинают ходить по сети и всем рассказывать как это круто, вакцины!
Люди, которые никогда не интересовались ни биологией, ни вирусологией, - вдруг начинают ходить по сети и всем рассказывать как это круто, вакцины!  ...
...



