Есть ли связь обмена железа с течением СOVID-19?
Ю. П. Орлов1, В. Т. Долгих2, Е. И. Верещагин3, В. Н. Лукач1, Н. В. Говорова1, В. Н. Кохно3, А. Н. Шмаков3, Я. Н. Патюков4
1ФГБОУ ВО «Омский государственный медицинский университет» МЗ РФ, г. Омск, РФ
2Научно-исследовательский институт общей реаниматологии им. В. А. Неговского ФНКЦ РФ, Москва, РФ
3ФГБОУ ВО «Новосибирский государственный медицинский университет» МЗ РФ, г. Новосибирск, РФ
4ГБУЗ «Нижневартовская окружная больница No 2», г. Нижневартовск, РФ
Цель: по данным литературы провести анализ возможных эпидемиологических и молекулярных механизмов, ответственных за гипервоспаление у пациентов с тяжелой формой COVID-19, связанных с нарушением метаболизма железа.
Результаты: подчеркивается сходство между COVID-19 и гиперферритинемическим синдромом, что позволяет рассматривать патогенез COVID-19 с прямым участием метаболизма железа. Очевидно, что при инфекции COVID-19 средней степени тяжести и особенно при тяжелых формах использование хелаторов железа и других методов элиминации свободного железа имеет обоснованные показания.
Ключевые слова: CОVID-19, цитокиновый шторм, метаболизм железа, гиперферритинемия, хелаторы железа
Для цитирования: Орлов Ю П, Долгих В Т, Верещагин Е И, Лукач ВН, Говорова Н В, Кохно В Н, Шмаков А Н, Патюков Я Н
Для корреспонденции :Орлов Юрий Петрович E-mail: orlov-up@mail.ruCorrespondence:Yury P. Orlov Email: orlov-up@mail.ru
Продолжающаяся пандемия [8, 10, 11, 13] новой коронавирусной инфекции (COVID-19) поставила несколько вопросов перед специалистами по интенсивной терапии: с чем связана вирулентность данного вируса, почему происходит цитокиновый шторм, почему преимущественно тяжелое течение имеет место у пожилых пациентов и у более молодых, но страдающих сопутствующей хронической патологией, что является патогенетической терапией у пациентов с СOVID-19, почему широко используемая кислородотерапия не приносит должного эффекта?
1. С чем связана вирулентность СOVID-19?
По всей видимости, вирулентность SARS-CoV-2 связана с его зависимостью от железа, что в принципе характерно не только для вирусов, но и для бактерий, грибов и многих паразитов, в том числе для возбудителя малярии [8, 10, 11, 13, 14, 17, 18].Поскольку железо участвует во многих биологических процессах, включая синтез ДНК/РНК и генерацию АТФ, вирусы в основном нуждаются в железе для своей репликации в клетках-хозяевах [6].Таким образом, происходит активная конкуренция между вирусом и «хозяином» в борьбе за железо. Несмотря на то что пока мало известно об уровне содержания железа у пациентов с атипичной пневмонией (SARS-CoV-2), некоторые данные могут быть получены из анализа клинического течения других вирусных инфекций. Однако, что касается SARS-CoV-2, то можно уже отметить, что из 613 пациентов анемия имела место только у 29 пациентов, что составило всего 15%. Таким образом, пациенты с анемией находятся вне группы риска.
Напротив, у большинства пациентов с SARS-CoV-2 отмечается высокий уровень ферритина в сыворотке крови; он оказался выше нормативных значений у 80% из общего числа больных, у 96% пациентов с отрицательным результатом и у 71% пациентов с положительным результатом теста на COVID-19.
Это рассматривается авторами как фактор риска госпитальной летальности [43]. Точно также и состояние перегрузки железом было и будет тесно связано с неблагоприятным прогнозом у больных на фоне течения вирусного гепатита В и С или инфицированных ВИЧ [20, 37]. Так, в исследовании B A Haider (2019) установлено, что добавление железа (для лечения анемии) увеличивает летальность ВИЧ-инфицированных пациентов независимо от тяжести анемии, что свидетельствует о пагубной роли избытка железа в патогенезе ВИЧ-инфекции [22]. Репликация ВИЧ-1 зависит от ферментов клетки-хозяина, некоторые из которых участвуют в транскрипции, трансляции вирусной мРНК и в вирусной сборке, требующей железа [18]. Таким образом, вирулентность ряда РНК-содержащих вирусов непосредственно связана с метаболизмом железа, потому что репликация вируса требует присутствия железа.
2. Почему при тяжелом течении COVID-19 происходит цитокиновый шторм?
Для ответа на этот вопрос следует провести параллели между обменом железа при острых воспалительных заболеваниях и сепсисом, а также при отравлении гемолитическими ядами и препаратами железа. Связь обмена железа и воспалительных процессов достаточно хорошо изучена. В некоторых экспериментах in vivo отмечено, что длительное введение железа было ассоциировано с 3-кратным увеличением печеночной мРНК фактора некроза опухоли-альфа (TNF-α) у мышей и крыс [30]. Нагрузка железом у мышей также повышала экспрессию мРНК других провоспалительных цитокинов, таких как интерлейкин-6 (IL-6) и IL-1β [32, 38]. Доказано, что нарушения обмена железа и хроническая перегрузка им наблюдаются при ряде острых и хронических воспалительных заболеваний. Большую опасность представляют случаи острого отравления железом и гемолитическими ядами. Появление свободного гемоглобина в кровотоке и/или свободного железа сопровождается каскадом патологических процессов, связанных как с самостоятельной активацией перекисного окисления липидов (ПОЛ), так и с активацией системной воспалительной реакции и ДВС-синдрома. В результате отмечается быстрое развитие синдрома полиорганной недостаточности с преимущественным поражением легких, почек и печени [2, 19].
Таким образом, при повышении уровня железа или свободного гемоглобина в сыворотке крови отмечается выраженная системная воспалительная реакция. Однако провоспалительные цитокины также запускают механизмы, способные снизить уровень внеклеточного железа. По данным F.Tacke (2016), дисбаланс в метаболизме железа быстро возникает наряду с воспалительным процессом, о чем свидетельствует снижение содержания железа и повышение уровня ферритина, sTfR, гепсидина и ИЛ-6 в плазме в 1-ю неделю после поступления пациентов в отделение реанимации и интенсивной терапии [36].
Гепсидин, основной регулятор внеклеточного тканевого уровня железа, индуцирует высвобождение железа из макрофагов и абсорбцию железа в кишечнике. Однако выработка гепсидина может регулироваться не только системной доступностью железа и эритропоэтическими сигналами (ERFE, GDF15 и TWSG1), но и воспалительными цитокинами (IL-6 и IL-1β) [24]. Двусторонняя связь метаболизма железа и воспалительных процессов на внеклеточном уровне очевидна и достаточно хорошо изучена. В последние годы раскрыты клеточные механизмы взаимосвязи гомеостаза железа и воспалительных процессов, а ключевая роль в гомеостазе железа отводится макрофагам.
Показано, что макрофаги являются тканевым депо железа благодаря механизмам активного рецепторного поглощения трансферрина и ферритина.
Макрофаги (преимущественно второго типа, М2) продуцируют в большом количестве ферропортин, участвующий в экспорте свободного железа и поддержании его стабильного внеклеточного уровня. Характерно, что способность активировать антиген-специфичные Т-клетки у макрофагов 2-го типа проявляется именно в присутствии железа.
В свою очередь тканевой обмен железа регулирует активность и поляризацию макрофагов либо в фенотип М1, либо в М2 [15, 18]. Данные о том, что метаболизм железа имеет отношение к активации и поляризации макрофага, приводят и другие авторы [23, 27, 45]. Более того, при перегрузке железом резидентные макрофаги переходят в активное состояние даже без классической активации провоспалительными цитокинами.
В реализации этого феномена участвуют несколько механизмов.
С одной стороны, перегрузка железом вызывает повышенную генерацию активных форм кислорода, что сопровождается увеличением экспрессии и ацетилирования белка р53, играющего ключевую роль в активации и поляризации макрофага [44], с другой ‒ железо является кофактором железосодержащей липоксигеназы (5-LOX), ответственной за генерацию лейкотриенов.
Доказано, что активация железом макрофагальной 5-LOX связана с рядом острых и хронических воспалительных заболеваний, а также онкологическими заболеваниями и атеросклерозом, причем активность проявляет как Fe3+, так и гемин
Напротив, использование хелатора железа деферроксамина устраняло повышенную активность липоксигеназы, переводя ее в форму, не связанную с клеточными мембранами [19].Еще одним хорошо изученным механизмом, который связывает железо с воспалением, является воздействие железа на ядерный фактор-kB (NF-kB).NF-kB (ядерный фактор kappa-B или фактор транскрипции) является фактором транскрипции провоспалительных цитокинов, таких как TNF-α и IL-6. В культуре изолированных клеток Купфера введение железа само по себе стимулировало активность NF-kB и повышало концентрацию TNF-α [9, 41].
При COVID-19 отмечено увеличение содержания трансферрина, что косвенно свидетельствует о повышении уровня внеклеточного железа. В данном случае источником может быть не только гемовое железо. Следует также помнить о миоглобине как источнике свободного железа [18]. На данный источник указывает характерный тип жалоб пациентов с COVID, а именно интенсивные мышечные боли.
Кроме того, снижение мышечный массы (так называемый аутоканнибализм) является характерной чертой и синдрома системного воспаления, и тяжелых вирусных инфекций [43]. Не следует также забывать, что часть пациентов имеют исходную перегрузку железом, о чем будет подробно изложено в следующем разделе. Кроме того, инфекция с SARS-CoV-2 приводит к увеличению уровня IL1-β, IFN-γ, IP10, индукция которых может способствовать продукции гепсидина, что в свою очередь может привести к секвестрации железа в макрофагах с активацией цитокинового шторма. В данном случае цитокиновый шторм может рассматриваться как синдром активации макрофагов [33].
Синдром активации макрофагов, также называемый гемофагоцитарным лимфогистиоцитозом, представляет собой тяжелый гипервоспалительный процесс, вызываемый в большинстве случаев инфекционными агентами, характеризующийся высокими уровнями ферритина и выраженной гиперцитокинемией: IL-1β, ИФН-γ, ФНО-α, IL-10, IL-6, IL-18, IL-2 и IL-12 [28].
В отличие от других классических вариантов гемофагоцитарного лимфогистиоцитозома, при синдроме активации макрофагов всегда имеются тяжелая сердечная недостаточность, выраженная коагулопатия, высокие уровни С-реактивного белка, IL-1β, IL-6 и TNF-α [32].Синдром активации макрофагов, как и другие формы гемофагоцитарного лимфогистиоцитозома, характеризуется длительной лихорадкой, гепатоспленомегалией, высоким уровнем ферритина, трансаминаз и билирубина, а также высоким уровнем фибриногена в сыворотке крови [15, 28].
По существу, все перечисленные признаки характерны для пациентов с тяжелыми формами COVID-19 [35].
3. Почему преимущественно тяжелое течение имеет место у пожилых пациентов и у более молодых, но страдающих сопутствующей хронической патологией?
На этот вопрос тоже можно ответить с позиций связи циркулирующего вируса с железом. По-видимому, ведущим фактором является накопление железа в процессе жизни. Чем длительней период жизни, тем больше депонируется железа, поскольку скорость его элиминации из организма уменьшается [25, 40]. С возрастом происходит атрофия мышц на фоне гипокинезии, а это способствует накоплению железа, которое за счет своих физико-химических свойств потенцирует окислительный стресс через реакции Хабера ‒ Вайса и Фентона [10, 39]. При исследовании крыс в возрасте от 29 до 37 месяцев содержание не гемового железа в икроножной мышце увеличилось на 200% с сопутствующим значительным увеличением окисленной мРНК [34]. В исследованиях, проведенных в той же лаборатории, окисление негемового железа и мРНК значительно увеличивалось с возрастом в митохондриях, полученных из четырехглавой мышцы [34]. Железо с возрастом накапливается и в легких, где повышение уровня гема (Fe3+) может способствовать увеличению частоты пневмоний, легочного фиброза и бронхогенной карциномы, наблюдаемых среди пожилых людей [21].
Второй важный фактор – наличие у более молодых пациентов сопутствующей патологии, прямо связанной с избытком железа в организме [39]. За последние полвека отмечено, что избыточное/нерациональное потребление железа является фактором риска увеличения числа и разнообразия заболеваний.
В начале 2008 г опубликован обширный перечень условий и типов железных ассоциаций.
В течение последующего года было признано, что железо усиливает еще четыре расстройства: атрофия стареющих мышц, вирусная репликация, розацеа (или демодекоз) и легочный альвеолярный протеиноз. В ходе исследования A. J. Ghio (2008) проведено сравнение образцов бронхоальвеолярного лаважа 20 пациентов с пульмоноальвеолярным протеинозом с образцами 20 здоровых добровольцев. Концентрация железа у них повышена в 5 раз по сравнению с таковой у здоровых добровольцев, трансферрина ‒ в 10 раз выше, уровни рецептора трансферрина, лактоферрина и ферритина также были статистически значимо повышены в смывах пациентов по сравнению со здоровыми лицами. Напротив, количество аскорбата, глутатиона и урата значительно снижено, что свидетельствует об истощении антиоксидантной системы. Полученные результаты свидетельствуют о наличии окислительного стресса, индуцируемого железом, при поддержании пульмоноальвеолярного протеиноза [22].
4. Почему широко используемая кислородотерапия не приносит должного эффекта?
Легкие представляют собой уникальную проблему для гомеостаза железа. Все дыхательные пути находятся в непосредственном контакте с окружающей средой и ее железными частицами и микробами, использующими железо. Легочный эпителий подвергается воздействию вдыхаемого воздуха, содержащего железные частицы и инфекционные патогены, а также является частью тонкого воздушно-кровяного барьера, газообменная функция которого подвержена постоянному повреждению вследствие цитотоксических воздействий [34]. Таким образом, биодоступность легочного железа должна быть строго регламентирована, чтобы предотвратить его использование микробами во время инфекции и обеспечить секвестрацию каталитически активного железа для предотвращения цитотоксичности [21]. Терминальная дыхательная единица, альвеола, состоит из трех типов клеток, активных в поддержании гомеостаза железа легких: типы 1 и 2 альвеолярных эпителиальных клеток и альвеолярных макрофагов. Альвеолярные макрофаги защищают от легочных инфекций, а также опосредуют повреждение и репарацию паренхимы легких. Кроме того, альвеолярные макрофаги являются депо железа в легких [39]. A. Ghio (2003), обследуя больных острым респираторным дистресс-синдромом, также отметил, что концентрация общего и негемового железа повышена в лаважной жидкости больных. Кроме того, выявлены высокие концентрации гемоглобина, гаптоглобина, трансферрина, рецептора трансферрина, лактоферрина и ферритина.
Повышенные концентрации доступного железа при остром респираторном дистресс-синдроме могут приводить к деструкции тканей нижних дыхательных путей путем генерации окислителя [22], а присутствие еще одного мощного окислителя ‒ высоких концентраций кислорода [12], потенцирует деструктивный процесс и уменьшает положительный эффект кислородотерапии, особенно в условиях искусственной вентиляции легких (ИВЛ). Высокие концентрации кислорода могут быть токсичны для легких через такие патогенетические факторы, как усиление альвеолярно-капиллярной «утечки», фиброгенез, артериальная вазоконстрикция и продукция активных форм кислорода с последующим провоспалительным и цитотоксическим эффектами [31]. Кроме того, типичным для тяжелого течения COVID-19 является микрососудистый легочный облитерирующий тромбоваскулит. Как известно, это типовой патологический процесс, который независимо от причины (инфекция, сахарный диабет, иммунная патология и т. Д.) характеризуется тромбозом не только сосудов системы микроциркуляции, но и более крупных сосудов. Кроме гипоперфузии, вплоть до полной блокады кровотока происходит массивный гемолиз с появлением свободного гемоглобина и повышением уровня свободного железа. Создается порочный круг, когда железо инициирует воспалительный процесс, в том числе тромбоваскулит, а блокада микро- и макроциркуляции создает условия для гемолиза и повышения уровня свободного гемового железа в сыворотке крови [26, 42].
Как следствие, отмечается быстрое нарастание дыхательной недостаточности, при которой ИВЛ и оксигенотерапия недостаточно эффективны в связи с блокадой легочного кровотока.
5. Чем лечить пациентов с СOVID-19 и почему?
Как можно судить по первому опыту терапии тяжелых форм СOVID-19, современные подходы интенсивной терапии недостаточно эффективны. Более глубокое понимание патогенеза инфекции СOVID-19, в частности изучение роли железа в развитии тяжелых форм инфекции, может привести к улучшению и диагностики, и профилактики развития синдрома полиорганной недостаточности, использованию методов, показавших эффективность в терапии отравлений гемолитическими ядами и препаратами железа, а именно плазмафереза и хелаторов железа.
Основная цель использования хелаторов железа при развитии критических состояний, связанных с травматической болезнью, отравлением уксусной кислотой, острым панкреонекрозом, сепсисом, тяжелыми вирусными заболеваниями, ‒ уменьшить концентрацию ионизированного железа, что должно выражаться в профилактике интенсификации процессов свободнорадикального окисления и липопероксидации, лежащих в основе развития синдрома полиорганной недостаточности.
Известно, что хелаторы железа (ферипрон, десферал) при энтеральном или парентеральном приеме достоверно увеличивают продолжительность жизни у ВИЧ-инфицированных пациентов. Позитивные эффекты связывают с блокадой репликации вируса, поскольку участвующие в этом процессе ферменты являются железосодержащими. Кроме того, наиболее тяжелое течение вирусной инфекции отмечается, как правило, у пациентов с исходной перегрузкой железом. Авторы настоящего обзора предполагают, что хелаторы железа могут использоваться как адъювантная терапия у пациентов с тяжелыми формами COVID-19 [29].
Наиболее изученным парентеральным хелатором железа является дефероксамин (десферал) Препарат быстро связывает Fe2+, образуя водорастворимый комплекс ферриоксамин. Очень важно, что препарат связывает железо прочнее, чем трансферрин (0,01 мг связывает 9,35 мг элементарного железа). Препарат быстро проникает во внеклеточную жидкость, далее внутрь клетки, где связывает железо, чем предотвращает его активирующее влияние на процессы ПОЛ. Препарат показал высокую эффективность при отравлениях препаратами железа, гемолитическими ядами [1, 3, 7]. Клинический эффект дефероксамина при лечении пациентов с острым панкреатитом и абдоминальным сепсисом подтвержден рядом исследований [4‒6]. В частности, в группе, где проводилась сочетанная терапия с включением дефероксамина в программу интенсивной терапии, ее эффективность была на 41% выше аналогичного показателя в группе сравнения. Препарат не токсичен, при парентеральном использовании описаны лишь единичные аллергические реакции [4‒6]. Клинические исследования по применению десферала продолжаются в настоящее время в Иране у пациентов как с легким, так и с тяжелым течением COVID-19 (NCT04333550) [16].
Заключение
COVID-19 может рассматриваться как системная воспалительная реакция, которая характеризуется угрожающим жизни гипервоспалением и цитокиновым штормом, который в конечном итоге приводит к полиорганной недостаточности. Причиной цитокинового шторма у больных COVID-19 может быть перегрузка железом (гиперферритинемия) как гемовым, так и свободным. Перегрузка железом у больных COVID-19 может быть как исходной, так и следствием «аутоканнибализма», т. Е. за счет гемового и миоглобинового железа. При системном воспалении возникает эффект секвестрации железа в макрофагах с последующей гиперактивацией и развитием цитокинового шторма. Вероятнее всего, при тяжелых формах COVID-19 имеют место все три механизма. Хелаторы железа уже использовали при адъювантной терапии ВИЧ-инфекции с достоверным позитивным результатом. Очевидно, что и при инфекции COVID-19 средней степени тяжести и особенно при тяжелых формах использование хелаторов железа и других методов элиминации свободного железа обосновано. Необходимо глубокое изучение метаболизма железа при COVID-19 и его связи с системной воспалительной реакцией.
Л И Т Е РАТ У РА
1. Баранов А. А., Багненко С. Ф., Намазова-Баранова Л. Р. и др. Клинические рекомендации по оказанию скорой медицинской помощи при отравлениях у детей // Педиатрическая фармакология. ‒ 2015. ‒ Т. 12, No 6. ‒ С. 657–667.
2. Маянский А. Н., Маянский Д. Н. Очерки о нейтрофиле и макрофаге. Новосибирск: Наука, 1989. – 324 с.
3. Орлов Ю. П. Патогенетическая значимость нарушенного обмена железа при критических состояниях: Дис. ... д-ра мед. наук. ‒ Омск, 2009.
4. Орлов Ю. П., Долгих В. Т. Метаболизм железа в биологических системах (биохимические, патофизиологические и клинические аспекты) // Био-медицинская химия. – 2007. – Т.53, No 1. – С. 25–38.
5. Орлов Ю. П., Долгих В. Т., Глущенко А. В и др. Роль сывороточного железа в активации процессов липопероксидации при критических состояниях // Общая реаниматология. – 2006. – Т. 2, No 3. – С. 18–22.
6. Орлов Ю. П., Долгих В. Т., Лукач В. Н. и др. Роль нарушенного обмена железа в манифестации органных расстройств и сепсиса при остром панкреатите // Общая реаниматология. – 2010. – Т. VI, No 5. – С. 62–68.
7. Орлов Ю. П., Орлова Н. В., Михеев Е. Ю. Отравления уксусной кислотой. Новый взгляд на старую проблему «русской болезни»: Методическое пособие для врачей. ‒ Санкт-Петербург: Тактик-Студио, 2015.
https://www.vair-journal.com/jour/article/view/448

 ещё : ночью не сидеть в интернете, физкультура, прогулки на свежем воздухе, не курить, не переедать, спать ложиться вовремя
ещё : ночью не сидеть в интернете, физкультура, прогулки на свежем воздухе, не курить, не переедать, спать ложиться вовремя а как же тестирование?
а как же тестирование?
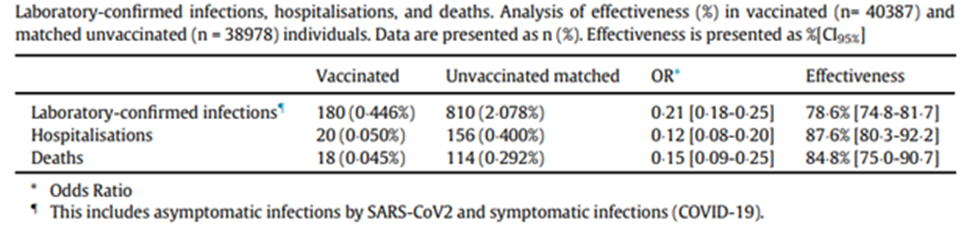
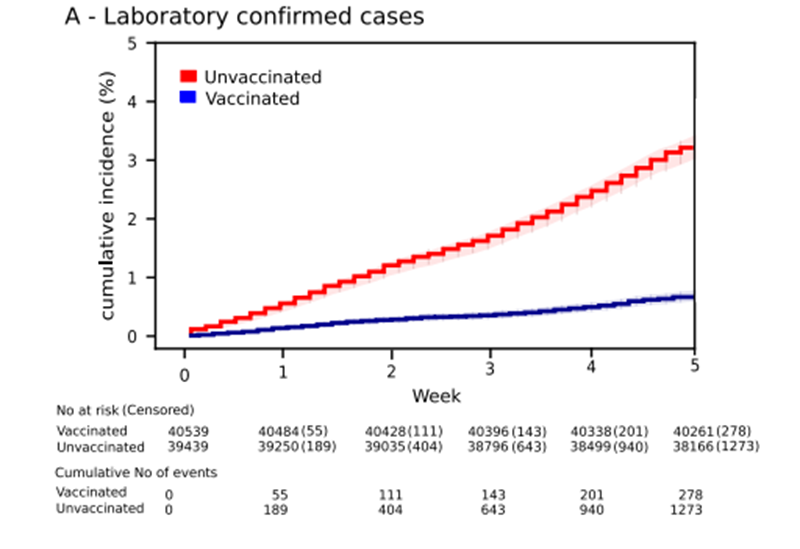
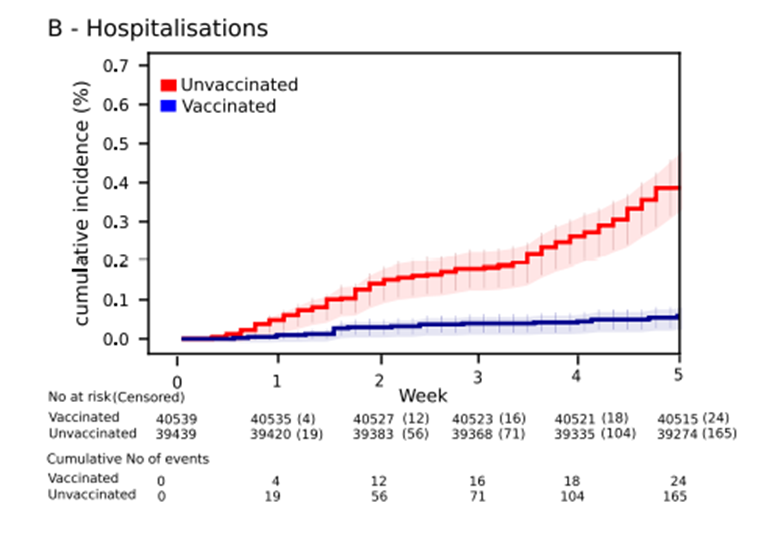
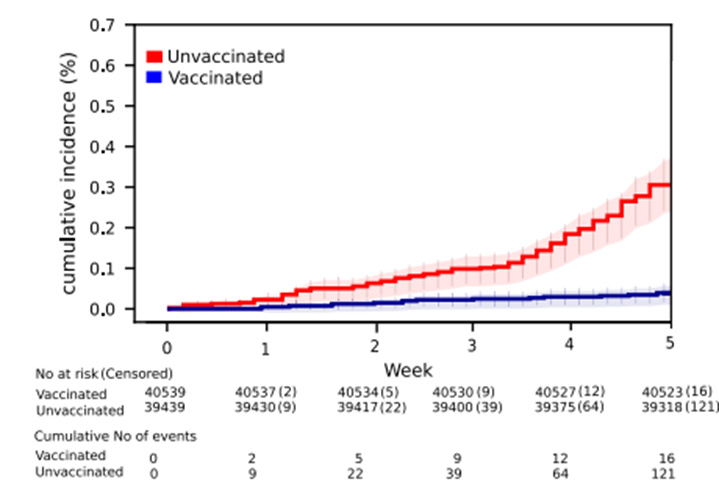




 . ГУФы да что вы всё пристали к ВАГУФу Goodilу с такими вопросами.
. ГУФы да что вы всё пристали к ВАГУФу Goodilу с такими вопросами. 





